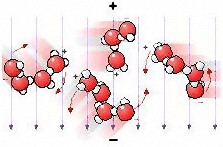
Den
första värmningsmekanismen
beror på
att molekylerna i en polär vätska »hakar
i»
varandra på grund av molekylens ojämna
laddningsfördelning så att ena änden blir
plus- och
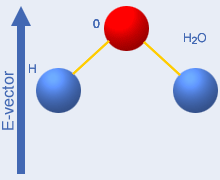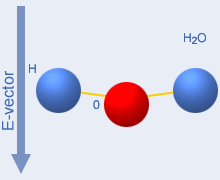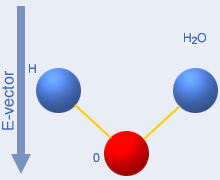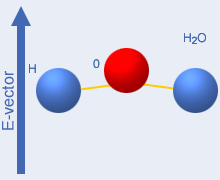
andra minusladdad – se bilden till höger som visar
vattenmolekyler. Mikrovågsfältet (+ och –
i bilden
samt nedåtriktade pilar) kommer då att
utöva en
vridande kraft på molekylgrupperna – de
försöker
ställa in sig efter fältet och energi
tillförs dem.
Då fältet växlar riktning, som vid 2450 MHz
sker 4,9
miljarder ggr/sek, återger de sin energi till fältet
–
systemet beter sig som en elektrisk kondensator som ansluts till
växelspänning. Är fältfrekvensen
mycket
hög hinner molekylgrupperna dock inte börja
ställa
in sig efter fältet – ingen
energiöverföring sker.
I ett visst frekvensintervall kommer molekylgrupperna att få
en
viss eftersläpning, som också beror på
deras
masströghet. Då kommer hela energin inte att
återvinnas då fältriktningen kastats om.
Fenomenet
kallas dipolrelaxation.
För vatten gäller att maximal
absorptionsförmåga
är vid ca 20 000 MHz. Vid 2450 MHz är den
»lagom», dvs sker succesivt ner till ca 20 mm i
material med hög
vattenhalt. Absorptionen beror också på
temperaturen och minskar med
ökande temperatur, eftersom antalet vattenmolekyler som
häftar samman minskar med ökande
värmerörelse.
De två nedersta, rörliga bilderna till
höger visar vad
som inte sker med mikrovågor. Enkel rotation
förekommer inte
för mikrovågor, eftersom molekylerna
oupphörligen
kolliderar. Flexningen som visas till höger är det
som sker
då de enskilda vattenmolekylerna värms av
infraröda
vågor, med våglängden 1…5
µm. Denna
mekanism gör att vatten i genomsikt är
blått
(komplementfärgen). Bildena är från den
här utomordentliga
»vattensajten», resp. Peter Püschners industriella
mikrovågs-sajt. |
|
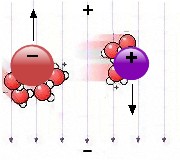
Den andra
värmningsmekanismen beror
på att det i många
vätskor (exv. vatten) kan finnas lösta salter, syror
eller
baser som delas upp (dissocieras) i laddade joner. Jonerna kommer att
påverkas av ett elektriskt fält så att de
vill
röra sig i dess riktning – se bilden till
höger som
visar en negativ jon (exv. kloridjonen i vanligt salt) och en positiv
jon (exv. natrium).
Att jonerna får en netto-tillskottsrörelse
är detsamma
som att temperaturen ökar, dvs elektrisk energi omvandlas till
värmeenergi. Denna verkan är oberoende av frekvensen.
Den
joniska (eller elektrolytiska) ledningsförmåga man
mäter kan direkt räknas om till en del av
mikrovågsabsorptionsförmågan. Denna
ökar med
ökande temperatur, eftersom den avskärmning som
påhäftade vattenmolekylgrupper åstadkommer
minskar
då antalet molekyler per grupp ökar
– jonerna
blir mer »nakna».
Mekanismen som beskrivits här kallas jonisk
ledningsförmåga. |
 |
| I vanliga
livsmedel står de båda mekanismerna vardera
för ca
hälften av
mikrovågsabsorptionsförmågan, trots
att salthalten typiskt är ca 0,6 % eller något
lägre.
Det sker en gynnsam kompensation eftersom de två
mekanismerna har olika temperaturberoende, enligt ovan.
– Diagram:(högupplöst PNG; enklare
PDF). Tabell
med andra materialdata. |
Läs
här om
de två andra värmningsmekanismerna och om
varför mikrovågor »bara»
värmer. |